Химические свойства воды в аквариуме должны быть максимально приближенными к естественной среде, в которой живут и размножаются определенные виды рыб. Большинство рыб, содержащихся в условиях аквариума, живут в воде средней жесткости — 10—15°.
Степень жесткости воды определяется по количеству содержащихся в ней солей кальция и магния. По ГОСТу жесткость берется в миллиграмм-эквивалентах кальция или магния один литр воды (1 мг-экв жесткости соответствует 20,4 мг/л кальция или 12,16 мг/л магния).
Жесткость величиной в один русский или немецкий градус равна 0,35663 мг-экв/л, французский — 0,19982, английский — 0,28483, американский — 0,01998 мг-экв/л
Практически принято считать жесткость в градусах: от О до 4° — очень мягкая вода; от 4 до 8° — мягкая; от 8 до 12° — вода средней мягкости; от 12 до 18° — жесткая; от 18 до 30° — очень жесткая.
Жесткость, характеризующая количество содержащихся в воде солей кальция и магния (связанных с углекислотой), называется карбонатной.
Различают жесткость постоянную и временную. Временная, или карбонатная,— это такая жесткость, которая соответствует количеству карбонатов кальция и магния, выпадающих в осадок при кипячении воды. Кальциевые соли сильных кислот (серной и др.) при кипячении в осадок не выпадают. Жесткость, зависящая от них, называется постоянной. Сумма карбонатной и постоянной жесткости называется общей жесткостью.
Соли кальция и магния необходимы для построения всего организма рыбы, нормального развития ее именно в пределах жесткости воды того водоема, откуда произошел данный вид.
Большинство рыб, живущих в аквариумах, уроженцы рек и озер тропических и. субтропических стран, воды которых неоднородны по своему химическому составу. Хозяйственно-питьевая вода, употребляемая в аквариумах, тоже имеет разное количество солей.
Величина жесткости в естественных водоемах колеблется в широких пределах. Например, в озерах и реках после выпадения атмосферных осадков вода становится мягче. Весной, после таяния снега, жесткость воды резко снижается.
Смягчение воды производится путем разбавления ее дистиллированной (дождевой, снеговой) водой или химическими веществами, осаждающими кальциевые соли.
Вода, кипяченная в течение часа, остуженная и хорошо отстоявшаяся, а затем на 1/3 объема слитая (со дна сосуда) при помощи сифона, будет иметь в два раза меньшую жесткость, чем до кипячения. Смягчить воду можно также путем замораживания, давая замерзнуть верхнему слою воды на 1/2 сосуда, а затем нижний слой слить. Полученная из этого льда вода будет иметь жесткость около 2—2,5°. Смягчать воду можно и химическим путем, применяя трехфосфорнокислый натрий. Осаждая соли, он одновременно несколько подкисляет воду (берут 0,8 г трехфосфорнокислого натрия на литр воды при жесткости исходной воды 18°).
Вода дождевая (снеговая), собранная после 2—3-часового может быть приравнена к дистиллированной, если в местах сбора ее нет сильного загрязнения воздуха газами. Но и этой воде следует дать хорошо отстояться, после чего профильтровать. Полное обессоливание воды получают при двойном дисциллировании, используют для этой цели также ионообменные колонки (как дистиллятор, так и ионообменные колонки можно приобрести в магазинах).
Прежде чем приступить к смягчению, нужно точно знать жесткость имеющейся (исходной) воды. Предположим, что исходная вода имеет жесткость 10°, а вам нужна вода жесткостью в 3°. В этом случае необходимо взять столько частей водопроводной воды, сколько должно быть градусов в итоге, т. е. 3 части дистиллированной добавить в количестве, равном разности градусов, 10—3=7 частей. Если за одну часть примем 1 л, тогда всего воды жесткостью 3° будет 10 л.
Используя имеющиеся практические таблицы, можно составить необходимую жесткость воды. Для этого водопроводная вода подогревается до 90° в течение 30—40 минут, охлаждается и смешивается с обессоленной в соответствии с данными, приведенными в таблице 1.
В нашем примере водопроводная вода имеет жесткость 10°, требуется смягчить ее до 3°. Находим в вертикальной графе цифру «3», а в горизонтальной цифру «10». Пересечение этих двух цифр укажет число 2333, соответствующее миллилитрам обессоленной воды, которые требуется добавить на 1 л водопроводной воды. Для определения жесткости смешиваемой воды и пропорции могут быть использованы математические формулы:
где
х — количество жесткой воды, л;
у — количество мягкой воды, л;
d — количество получаемой воды, град;
а — жестеость жесткой вод, град;
b — жесткость мягкой воды, град;
с — жесткость получаемой воды, град.
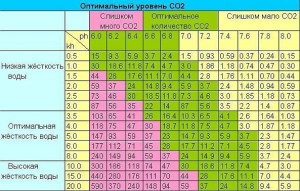
Зная данные исходной воды (жесткость, количество), по этим формулам можно определить остальные интересующие вас данные. Нормальная жизнедеятельность водных животных и растений зависит не только от жесткости, но и в большей степени от величины активной реакции воды (кислотности), в особенности в нерестовый период. Активная реакция воды обозначается латинскими буквами «рН» и измеряется весовым количеством водородных ионов. Чем меньше показатель рН, тем кислее будет вода. При нейтральной реакции показатель рН имеет потенциал рН 7 (в ней нет кислот или щелочей, а если и есть, то одинаковое весовое количество).
В зависимости от количества растворенных в воде солей и газов вода будет иметь различную химическую (активную) реакцию. Значит, и показатель рН — величина не постоянная. Чем выше жесткость, тем щелочнее вода. При соприкосновении поверхности воды с воздухом в ней энергичнее растворяются находящиеся в воздухе газы. Углекислого газа в воздухе 0,03—0,05%, а в воде в 80 раз больше — 4%. Кислорода в два раза больше, чем в воздухе. С увеличением температуры воды до 30° кислорода в воде в два раза меньше, чем в воздухе. Днем водные растения под воздействием света (происходит фотосинтез) поглощают углекислый газ — вода становится щелочней, а ночью поглощают кислород и выделяют углекислый газ — вода становится кислее. При падении атмосферного давления кислорода в воде растворяется меньше, чем углекислого газа, происходит подкисление воды. С изменением величины активной реакции воды у рыб изменяется процесс обмена веществ, в кислой среде понижается усвояемость пищи, затрудняется дыхание, а в щелочной среде понижается проницаемость наружных покровов для газов и солей. При ярком солнечном освещении в зарослях растений показатель рН достигает 10,6, а ночью из-за накопления углекислоты он может падать до 5,5. Это явление может привести к гибели рыб. Резкого изменения кислотности воды некоторые рыбы не переносят и погибают. Продувка воды воздухом (аэрация) обеспечивает равномерное распределение рН по всей толще воды, попадающий в воду углекислый газ будет находиться в растворенном состоянии.
Практически принято считать: рН от 1 до 3 — сильнокислая реакция; от 3 до 5 — кислая; от 5 до 6 — слабокислая; от б до 7 — очень слабокислая; рН 7 — нейтральная; от 7 до 8 — очень слабощелочная; от 8 до 9 — слабощелочная; от 9 до 10 щелочная и от 10 до 14 — сильнощелочная.
Измерения величины жесткости и кислотности воды можно производить самим при помощи наборов химреактивов для определения жесткости, кислотности воды в пресноводном аквариуме.